Los sulfatos presentes en la muestra de yeso se solubilizan por digestión con ácido clorhídrico en caliente y se precipitan por adición de una disolución de cloruro de bario, con lo que se obtiene un precipitado de sulfato de bario:
Para realizar ésta práctica se necesitarán los siguientes materiales y reactivos:
- vasos de precipitado de 250 y 400 mL
- crisoles de porcelana
- filtros de contenido de cenizas conocido
- embudo buchner
- balanza analítica
- mufla
- desecador
- HCl 2N
- BaCl₂ al 10%
- H₂O destilada
Pasos a seguir:
- Hervir 0.5 g de muestra junto con 30 mL HCL y 150 mL de agua destilada de 15 a 20 minutos.
- Filtrar la disolución para eliminar las impurezas y lavar con agua destilada caliente.
- Precipitar la disolución con 25 mL BaCl₂ al 10% y llevar a ebullición. Dejar en reposo al menos 12 horas.
- Pasado ese tiempo, volver a filtrar y lavar con agua destilada caliente hasta que no queden cloruros (que el filtrado no reaccione con AgNO₃).
- El resido obtenido se debe incinerar lentamente en un crisol previamente pesado y después calcinar a 800⁰C.
El yeso ensayado tiene un 42,84 % SO₃.
Según la información encontrada en la ficha de datos de seguridad, el yeso "el Duende" tiene un contenido de Sulfato cálcico semihidrato: Ca SO4 . ½ H2O mayor del 75%, con lo cual, nuestros resultados se acercan bastante al real.
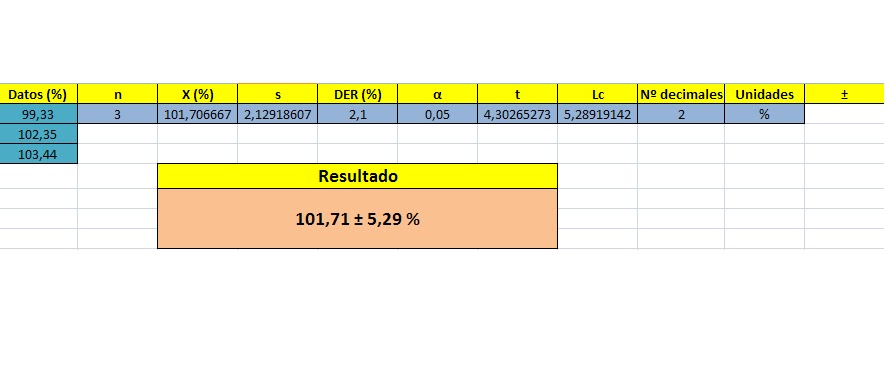
Comparamos los resultados obtenidos con los del resto de la clase:
Comparamos la media de los resultados de la clase con los el resultado del grupo para ver la exactitud y las varianzas, para determinar la precisión del método:
Según los resultados obtenidos en los cálculos estadísticos, y tomando mi resultado como real, los resultados de la clase no son ni precisos ni exactos ya que la media de los resultados se aleja de la real y su varianza es mayor, lo que indica que hay una mayor variabilidad en los resultados.
Se deben utilizar la bata, guantes y mantener una distancia de seguridad al trabajar con la mufla, utilizar gafas de seguridad y el pelo recogido cuando utilizamos el mechero y tener las precauciones necesarias al manipular el BaCl₂. Las fichas de seguridad del resto de los reactivos utilizados se pueden consultar en las prácticas anteriores.
Según los resultados obtenidos en los cálculos estadísticos, y tomando mi resultado como real, los resultados de la clase no son ni precisos ni exactos ya que la media de los resultados se aleja de la real y su varianza es mayor, lo que indica que hay una mayor variabilidad en los resultados.
Se deben utilizar la bata, guantes y mantener una distancia de seguridad al trabajar con la mufla, utilizar gafas de seguridad y el pelo recogido cuando utilizamos el mechero y tener las precauciones necesarias al manipular el BaCl₂. Las fichas de seguridad del resto de los reactivos utilizados se pueden consultar en las prácticas anteriores.